Resumen
El objetivo central de nuestro laboratorio es abordar desde la experimentación básica problemas relevantes a la fisiopatología y el tratamiento de la Enfermedad de Parkinson (EP), abordados desde la fisiología celular y molecular de los procesos involucrados en la patología y pensando en la transferencia como objetivo práctico. Actualmente centramos nuestras líneas de investigación en comprender dos grandes problemas de la EP: por un lado los mecanismos relacionados con la muerte y la sobrevida neuronal y por otro los efectos adversos asociados al tratamiento con Levodopa, principalmente el desarrollo de disquinesias.
Contamos con experiencia en el manejo de varios modelos de la EP, incluyendo líneas celulares, cultivos primarios de neuronas dopaminérgicas, moscas (Drosophila melanogaster) y ratones (salvajes, knock-out y transgénicos), sobre los que desarrollamos técnicas de biología molecular, bioquímica e histología.
Como resultado de las dos líneas de investigación en curso en los últimos años, hemos desarrollado una opción de terapia génica experimental contra las disquinesias inducidas por levodopa que consiste en el silenciamiento de la quinasa Fyn en el estriado de ratones mediante la tecnología de RNA interferente. Por otra parte, demostramos el efecto neuroprotector de extractos de yerba mate sobre neuronas dopaminérgicas en cultivo, reforzando las evidencias respecto a los efectos benéficos sobre la salud de este producto natural.
Líneas de investigación
Controlar las disquinesias inducidas por levodopa (LID) es uno de los grandes desafíos en el tratamiento de la EP. Varios cambios genéticos y bioquímicos fueron asociados con el fenómeno y varias evidencias apuntan a la interacción entre los receptores para dopamina y glutamato de las neuronas estriatales como la zona postsináptica crucial donde ocurre un rearreglo plástico que desencadenaría la aparición LID.
En nuestro laboratorio postulamos y demostramos que la proteína quinasa Fyn es un intermediario clave de este proceso. Fyn media la fosforilación del receptor NMDA inducida por el receptor D1 y PSD-95 regulando su localización intracelular y su capacidad funcional. La única opción terapéutica para el tratamiento de las disquinesias es el uso de antagonistas farmacológicos de NMDA que reducen su funcionalidad, sin embargo, el uso de los mismos no puede ser prolongado debido a su efecto generalizado y la aparición de nuevos efectos adversos. Nuestra hipótesis es lograr la reducción de la función de NMDA mediante una estrategia alternativa enfocada a reducir la función de fyn.
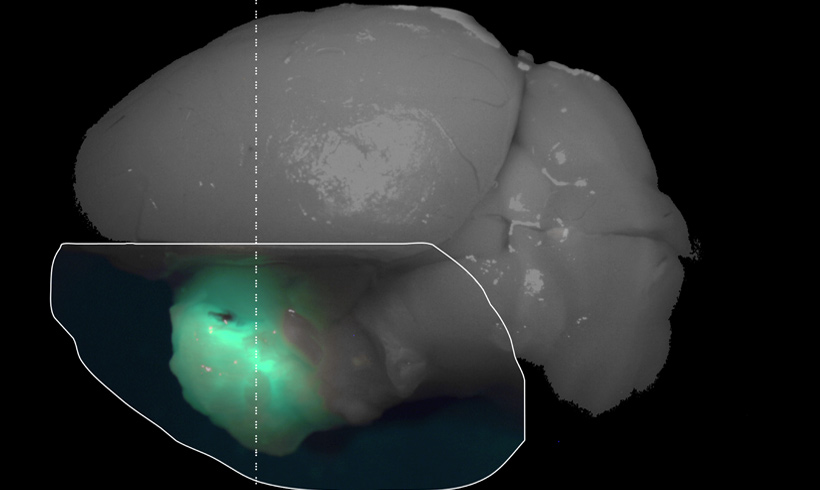
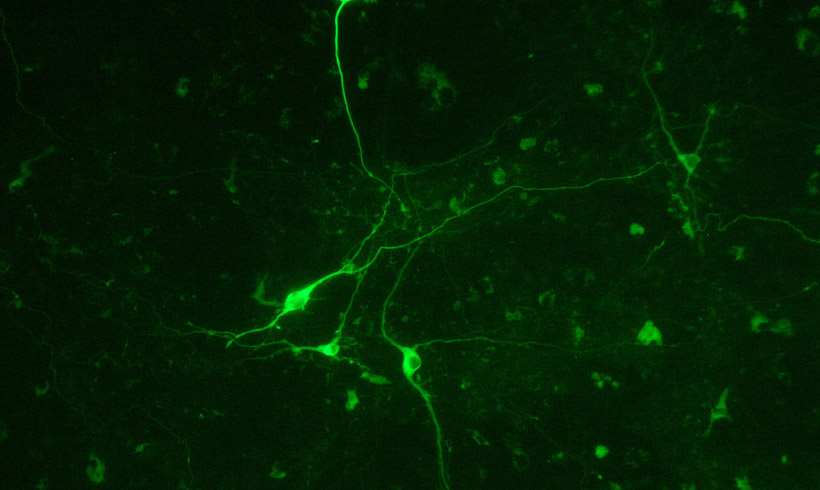
Recientemente hemos reproducido el modelo de disquinesias en ratones carentes de Fyn (KO-Fyn), demostrando una menor capacidad de estos ratones a desarrollar LID y la disminución de marcadores bioquímicos asociados con disquinesias (como FosB/ΔfosB). A su vez, demostramos que un inhibidor farmacológico de fyn previene el desarrollo de LID en ratones (Sanz-Blasco et al 2018). Actualmente desarrollamos un RNA interferente (RNAi) contra fyn, el cual encapsidamos en vectores lentivirales e inyectamos en el estriado de ratones modelo de la enfermedad de Parkinson y que desarrollan disquinesias. Determinamos que el silenciamiento de fyn es efectivo tanto para prevenir las LID en ratones como para revertir las disquinesias ya establecidas. Este trabajo (en revisión) es netamente experimental en ratones, sin embargo, genera expectativas como potencial opción terapéutica futura. (En colaboración con Elena Avale, INGEBI)
Las neuronas dopaminérgicas (DA) son más sensibles a la degeneración que otros tipos neuronales del sistema nervioso. Esta característica puede reproducirse en cultivos primarios mesencefálicos donde, en condiciones particulares, las neuronas DA mueren en un lapso de 7 a 14 días, mientras que otros tipos neuronales no. Esta particularidad lo convierte en un interesante modelo in vitro para estudiar mecanismos de neuroprotección para las neuronas DA.
En el laboratorio estudiamos potenciales condiciones neuroprotectoras y los mecanismos celulares y moleculares involucrados en la sobrevida neuronal. Entre diversos potenciales agentes neuroprotectores, evaluamos el efecto de un extracto de yerba mate (YM) y encontramos que el mismo tiene un poderoso efecto neuroprotector sobre neuronas dopaminergicas en cultivo. A su vez, probamos ciertos principios activos presentes en el extracto de YM, determinando un efecto similar, aunque de menor magnitud (Bernardi et al. 2019). Actualmente estamos estudiando las vías de señalización intracelular disparadas por la exposición al extracto con YM como también evaluando el efecto de la ingesta de YM por parte de moscas D. melanogaster, modelo de la enfermedad de Parkinson (en colaboración con Nara Muraro, IbioBA).
La levodopa es el tratamiento farmacológico por excelencia para la Enfermedad de Parkinson, la cual revierte los síntomas motores, aunque luego de varios años induce la aparición de disquinesias inducidas por levodopa (LID) que impactan negativamente en la calidad de vida de los pacientes.
Las LIDs representan un problema clínico, pero también un gran desafío para la investigación. Nuestro grupo aborda el estudio de la fisiopatología de las LID a nivel celular y en particular de expresión génica desde hace dos décadas y hemos desarrollado nuevas herramientas moleculares efectivas en modelos preclínicos de la enfermedad.
En continuidad con esta línea experimental, La Dra. Bordone lidera un proyecto en colaboración con la Dra. Angela Cenci-Nilsson (Lund University, Suecia) y el Dr. Marcelo Martí (FCEN-UBA), donde retomamos el análisis masivo de expresión génica utilizando la novedosa tecnología de single nuclei RNA sequencing (snRNAseq) combinada con el análisis masivo de datos mediante herramientas bioinformáticas.
Realizamos snRNA-seq de muestras provenientes del estriado de ratones parkinsonianos tratados con L-dopa para inducir disquinesias, de donde obtuvimos los perfiles transcripcionales específicos de cada tipo celular del estriado, incluyendo tipos neuronales y no neuronales, en cada condición experimental. Identificamos y anotamos los diferentes clústers y estamos en proceso de análisis de expresión diferencial e identificación de funciones celulares para definir los perfiles de expresión de cada tipo celular, y poder generar un mapa de las vías celulares y funciones biológicas implicadas en Parkinson experimental y LID. Los resultados de este proyecto permitirán comprender mejor los profundos cambios que subyacen a las LID, y proponer nuevas y más precisas intervenciones terapéuticas.
Integrantes:
Lic. Hernán E. Hauché P.
hernanhauche@gmail.com
Becario Doctoral CONICET
Docente en UBA (Ay. de 1°)
LinkedIn Researchgate Orcid ID
Lic. Micaela B. Cuk
Micaelacuk@gmail.com
Licenciada en Cs. Biológicas
.
.
Gisela Mariel Decurgez
giseladecurgez@gmail.com
Tesista de Grado
Est. de Lic. en Cs. Biológicas
LinkedIn
Colaboradores:
- Oscar Gershanik – Hospital y Universidad Favaloro – Argentina
- Angela Cenci Nilsson – Lund University – Suecia
- Tiago Outeiro – University Medical Center Goettingen – Alemania
- Elena Avale – INGEBI – CONICET – Argentina
- Nara Muraro – IBioBa – CONICET – Argentina
Prensa:
- INFOBAE – Un estudio experimental del Conicet aporta nuevos datos en apoyo del posible efecto preventivo del mate sobre el desarrollo de la Enfermedad de Parkinson – 4 de Abril 2019
- NOTA CONICET – Nuevas estrategias para mejorar el tratamiento del Parkinson – 25 de Enero 2018
- INFOBAE – 200 años de la revolución de Parkinson – 11 de Abril 2017